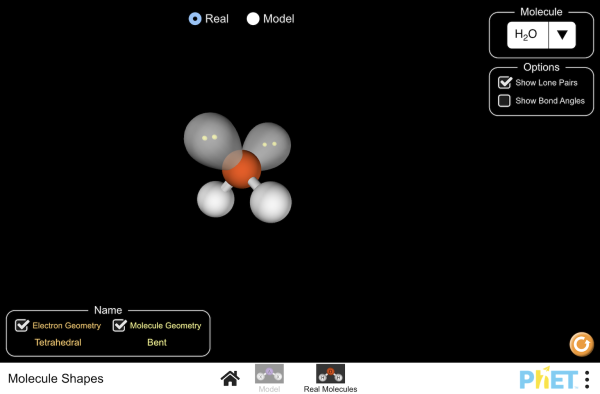
CONSTRUCTOR DE MOLÉCULAS
Animación para ver la geometría de las moléculas:
ENLACE PHET
CURSO DE QUÍMICA 2.0
jueves, 16 de marzo de 2017
MODELOS ATÓMICOS
MODELOS ATÓMICOS 1
MODELOS ATÓMICOS 2
BRIAN COX EXPLICA LOS MODELOS ATÓMICOS.
REPASO DE LOS MODELOS ATÓMICOS HASTA BOHR
EXPERIMENTO CON TUBOS DE RAYOS CATÓDICOS
EXPERIMENTO DE LA GOTA DE ACEITE DE MILLIKAN
Determinación de la masa y la carga del electrón.
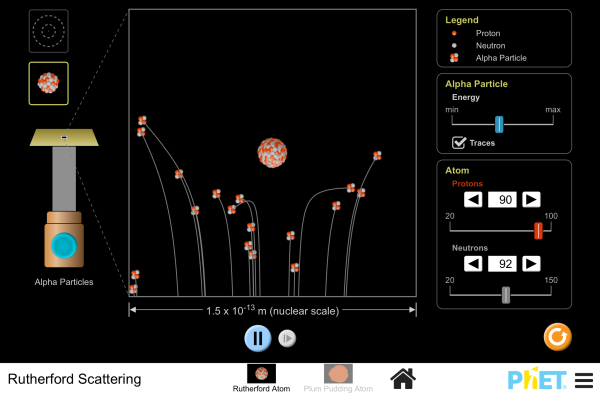
EXPERIMENTO DE MARSDEN, GEIGER Y RUTHERFORD, CON LA LÁMINA DE ORO
DISPERSIÓN DE RUTHERFORD
ESPECTROS ATÓMICOS
Entrada del BLOG de 1º de Bachillerato: ENLACE.
ENLACES WIKIPEDIA:
1900 Constante de Planck
1904 Efecto fotoeléctrico
1913 Modelo atómico de Bohr
1924 De Broglie: dualidad onda-corpúsculo
1925 Heisenberg: "Principio de Incertidumbre"
1925 Ecuación de Schrödinger
MODELOS ATÓMICOS 2
BRIAN COX EXPLICA LOS MODELOS ATÓMICOS.
REPASO DE LOS MODELOS ATÓMICOS HASTA BOHR
EXPERIMENTO CON TUBOS DE RAYOS CATÓDICOS
EXPERIMENTO DE LA GOTA DE ACEITE DE MILLIKAN
Determinación de la masa y la carga del electrón.
EXPERIMENTO DE MARSDEN, GEIGER Y RUTHERFORD, CON LA LÁMINA DE ORO
DISPERSIÓN DE RUTHERFORD
ESPECTROS ATÓMICOS
[ORIGEN DE LA IMAGEN: ENLACE]
[ORIGEN DE LA IMAGEN: ENLACE]
Entrada del BLOG de 1º de Bachillerato: ENLACE.
ENLACES WIKIPEDIA:
1900 Constante de Planck
1904 Efecto fotoeléctrico
1913 Modelo atómico de Bohr
1924 De Broglie: dualidad onda-corpúsculo
1925 Heisenberg: "Principio de Incertidumbre"
1925 Ecuación de Schrödinger
martes, 17 de enero de 2017
ÁCIDOS Y BASES
DISOLUCIONES DE ÁCIDOS Y BASES
[ORIGEN DE LA ANIMACIÓN: PHET INTERACTIVE SIMULATIONS]
ESCALAS DE pH
[ORIGEN DE LA ANIMACIÓN: PHET INTERACTIVE SIMULATIONS]
[ORIGEN DE LA ANIMACIÓN: PHET INTERACTIVE SIMULATIONS]
ESCALAS DE pH
[ORIGEN DE LA ANIMACIÓN: PHET INTERACTIVE SIMULATIONS]
miércoles, 4 de marzo de 2015
REACCIONES DE OXIDACIÓN REDUCCIÓN
PILAS VOLTAICAS, CELDAS GALVÁNICAS, CELDA VOLTAICA, PILAS ELECTROQUÍMICAS, CELDAS ELECTROQUÍMICAS, ...
PILAS VOLTAICAS / CELDAS GALVÁNICAS
Representación de pilas:
Ver
a pantalla completa
[FUENTE:salvadorhurtado.wikiespace] [LICENCIA: sin cambios]
Con todos estos nombre son conocidos los dispositivos que permiten obtener una corriente eléctrica a partir de una reacción REDOX.
Hay autores que no recomiendan usar el término CELDA ELECTROQUÍMICA porque aquí se incluirían también las celdas electrolíticas, en las que se consume energía en un proceso REDOX, que es un proceso forzado.
PILAS VOLTAICAS / CELDAS GALVÁNICAS
Representación de pilas:
[FUENTE:salvadorhurtado.wikiespace] [LICENCIA: sin cambios]
PILAS DE COMBUSTIBLE
Una aplicación tecnológica en la que se han puesto muchas esperanzas ha sido la llamada CELDA DE COMBUSTIBLE o PILA DE COMBUSTIBLE, en la que se consume hidrógeno haciéndolo reaccionar con oxígeno para formar agua; en el proceso se forma agua. El agua formada se puede descomponer por electrolisis formándose hidrógeno y oxígeno, recuperándose así el hidrógeno, que es el combustible. Si en la reconversión se usan fuentes renovables de energía el proceso es muy respetuoso con el medio ambiente.
[ORIGEN: RED ENERGÉTICA]
miércoles, 4 de febrero de 2015
VALORACIONES ÁCIDO-BASE
Una valoración ácido-base consiste en la determinación de la cantidad de ácido o de base que hay en una disolución. Las cantidades se suelen expresar como concentraciones. Como agentes valorantes se utilizan por lo general ácidos o bases fuertes.
Las curvas de valoración muestran como va cambiando el pH conforme se va añadiendo agente titulante. La figura muestra cómo varía el pH de una disolución de base que se está valorando con un ácido fuerte.
[FUENTE: WIKILLERATO]
Para determinar el punto final de la valoración o punto de equivalencia se utilizan los llamados indicadores. los cuales muestran un color diferente dependiendo del pH de la disolución. Una selección de indicadores se muestra en la tabla adjunta:
[FUENTE: LA QUÍMICA DE NACHO]
La elección del indicador es muy importante ya que su viraje debe de caer en la zona recta de la curva de valoración. En la imagen se muestra la zona de viraje de tres indicadores en la valoración de un ácido fuerte con una base fuerte. De los tres el menos indicado sería el anaranjado de metilo. La fenolftaleía y el rojo de metilo serían muy adecuados para esta valoración.
[FUENTE: SANITEX (imagen modificada)]
En la siguiente imagen se comparan las curvas de valoración de un ácido fuerte (HCl) y de un ácido débil (ácido acético). Como se observa el indicador para el ácido débil se debe de elegir con mucho cuidado ya que los pH iniciales son más elevados que para un ácido fuerte. Para el ácido débil no se podrían utilizar indicadores como el anaranjado de metilo o el rojo de metilo.
Aquí tienes una aplicación a la que pueden entrar para hacer unas valoraciones virtuales de ácidos y bases.
El video adjunto puede ayudar a visualizar la técnica de las valoraciones
TITULACIÓN DEL ÁCIDO ACÉTICO
En esta animación puedes hacer la valoración de una disolución de ácido acético.
NOTA: se necesita "Flash Player".
[ORIGEN DE LA ANIMACIÓN:www.freezeray.com]
jueves, 9 de octubre de 2014
GASES
GAS IDEAL
Un gas ideal es un gas teórico compuesto de un conjunto de partículas puntuales con desplazamiento aleatorio que no interactúan entre sí. El concepto de gas ideal es útil porque el mismo se comporta según la ley de los gases ideales, una ecuación de estado simplificada, y que puede ser analizada mediante la mecánica estadística.En condiciones normales tales como condiciones normales de presión y temperatura, la mayoría de los gases reales se comporta en forma cualitativa como un gas ideal. Muchos gases tales como el nitrógeno, oxígeno, hidrógeno, gases nobles, y algunos gases pesados tales como el dióxido de carbono pueden ser tratados como gases ideales dentro de una tolerancia razonable. Generalmente, el apartamiento de las condiciones de gas ideal tiende a ser menor a mayores temperaturas y a menor densidad (o sea a menor presión), ya que el trabajo realizado por las fuerzas intermoleculares es menos importante comparado con energía cinética de las partículas, y el tamaño de las moléculas es menos importante comparado con el espacio vacío entre ellas.
El modelo de gas ideal tiende a fallar a temperaturas menores o a presiones elevadas, cuando las fuerzas intermoleculares y el tamaño intermolecular es importante. También por lo general, el modelo de gas ideal no es apropiado para la mayoría de los gases pesados, tales como vapor de agua o muchos fluidos refrigerantes.
A ciertas temperaturas bajas y a alta presión, los gases reales sufren una transición de fase, tales como a un líquido o a un sólido. El modelo de un gas ideal, sin embargo, no describe o permite las transiciones de fase. Estos fenómenos deben ser modelados por ecuaciones de estado más complejas.
[Fuente: WIKIPEDIA]
GAS REAL
Un gas real, en oposición a un gas ideal o perfecto, es un gas que exhibe propiedades que no pueden ser explicadas enteramente utilizando la ley de los gases ideales. Para entender el comportamiento de los gases reales, lo siguiente debe ser tomado en cuenta:
- efectos de compresibilidad
- capacidad calorífica específica variable
- fuerzas de Van der Waals
- efectos termodinámicos del no-equilibrio
- cuestiones con disociación molecular y reacciones elementales con composición variable.
«Real Gas Isotherms» por Raoul NK - Trabajo propio. Disponible bajo la licencia CC BY-SA 3.0 vía Wikimedia Commons.
Suscribirse a:
Entradas (Atom)